一.复习建议
1、参照近三年高考试题,把握复习方向
2、知识的扩展不脱离课本,教材内容的深挖不超纲
3、重视化学与社会的联系,注重解决实际问题
二.关注2005年高考试题特点
1、基本概念、基本理论知识与元素化合物、实验、计算知识融合,以学科内综合的形式进行命题
2、综合题目难、中、易搭配合理、由易到难梯度明显,得分容易,得高分难,具有较好的区分度。
三.考点分析
I卷05题主要考点 化学与社会 热化学方程式 元素周期律综合知识
氧化还原的概念 电化学知识
离子共存、离子方程式 官能团与有机物的性质 摩尔、阿伏加德罗定律
化学基本实验 溶液 化学平衡判断
考点1:,化学与社会紧密联系——学科知识与解决实际问题围绕能源、资源、环境、健康、社会可持续发展设问
复习建议:1、注意对问题进行多角度思考和解决
2、训练审题、筛选信息的能力
1、近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂在470℃、80MPa 下合成出金刚石,具有深远意义。下列说法不正确的是
A、由二氧化碳合成金刚石是化学变化
B、金刚石是碳的一种同位素
C、钠被氧化最终生成碳酸钠
D、金刚石中只含有非极性共价键
2、高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是
A 臭氧和氧气是氧的同素异形体 B 臭氧可使湿润的KI淀粉试纸变蓝
C 臭氧的存在对人体有益无害 D 臭氧是很好的消毒剂和脱色剂
3、能与人体血液中血红蛋白结合的一种有毒气体是
A、氯气 B、氮气 C、一氧化碳 D、甲烷
4、现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理,②少用原煤做燃料,③燃煤时鼓入足量空气、,④开发清洁能源。其中能减少酸雨产生的措施的是
A ①②③ B ②③④ C ①②④ D ①③④
5、2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为中不符合这一主题的是
A、“绿色化学”工艺,使原料尽可能转化为所需要的物质
B、大量开采地下水,以满足社会对水的需求
C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D、节约能源,提高能源利用率
6、自来水厂对天然水进行净化消毒,通常使用液氯,有些不法商贩用自来水冒充“纯净水”销售,能检验出这种假冒纯净水的试剂是
7、铜锌合金制成的假金元宝欺骗行人的事件屡有发生,下列不易区别其真伪的方法是
A、测定密度 B、放入硝酸中 C、放入盐酸中 D、观察外观
8、为了使鱼苗顺利运输,必须满足三个条件:(1)需要保持适量的氧;(2)使鱼苗呼吸排出的二氧化碳气及时排出;(3)防止细菌大量繁殖。已知下列四种物质加入水中都可起到供氧杀菌作用,在长距离运输鱼苗时,最好在水中加入
A.过氧化钠 B.氯水 C.过氧化钙 D.双氧水
考点2:离子方程式和离子共存判断
近年考点:燃烧热的概念和计算、中和热的测定和计算、正确书写热化学方程式、判断热化学方程式的正误、反应热大小比较
复习建议
归纳拆什么——强酸、强碱、可溶性盐
归纳离子间不共存的原因
与H+不共存的离子: OH-、 AlO2-、 ClO-、 CO32-等多种弱酸根,HCO3- 等酸式根
与OH-不共存的离子: H+ 、NH4+、HCO3-、 Fe2+、 Cu2+
ClO-、 NO3- 的氧化性;
注意附加条件:有色离子、pH条件等
判断正误的一般方法:电荷、原子守恒,反应物过量
1.能用离子方程式H++OH-=H2O表示的反应是
A 稀醋酸和稀氨水反应 B 稀硫酸和烧碱溶液反应
C 稀盐酸和氢氧化铜反应 D 稀硫酸和氢氧化钡溶液反应
2.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+) =10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH =1的溶液中:K+、Fe2+、Cl—、NO3—
3.下列离子方程式正确的是
A 碳酸氢钠溶液中加入盐酸:CO32-+2H+→CO2↑+H2O
#B 硫化亚铁与盐酸反应:S2¯+2H+→H2S↑
C 苯酚钠溶于醋酸溶液:C6H5O¯+CH3COOH→C6H5OH+CH3COO¯ D 氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl¯
4、下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+ === Ca2+ + 2H2O
B.钠与水的反应Na + 2H2O === Na+ + 2OH -+ H2↑
C.铜片插入硝酸银溶液中Cu + Ag+ === Cu2+ + Ag
D.大理石溶于醋酸的反应CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O
5、下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加入过量氨水 Al3++30H-══Al(OH)3↓
B.电解饱和食盐水 2Cl-+2H2O H2↑+C12↑+20H-
C.碳酸钙与盐酸反应 CaCO3 + 2H +═ Ca2++ CO2↑ +H2O
D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液
Fe2++2H++H2O2══Fe3++2H2O
考点3:反应热、热化学方程式的应用
近年考点:燃烧热的概念和计算、中和热的测定和计算、正确书写热化学方程式、判断热化学方程式的正误、反应热大小比较
复习建议:帮助学生自己总结——书写热化学方程式与普通化学方程式的区别
⊿H数值的计算、正或负号的含义、
为什么必须注明物质的状态、什么情况下出现分数系数
1、已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
A 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2bkJ/mol
B C2H2(g)+5/2O2(g)=2CO2(g)+ H2O(l);ΔH=2bkJ/mol
C 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4bkJ/mol
D 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=bkJ/mol
2、氢气(H2)一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式分别如下
H2(g)+ 1/2 O2(g)= H2O(l);⊿H = -285.8kJ/ mol
CO(g)+ 1/2 O2(g)= CO2(g);⊿H = -283.0kJ/ mol
C8H18(g)+ 25/2 O2(g)= 8CO2(g)+ 9 H2O(l);⊿H = -5518kJ/ mol
CH4(g)+ 2 O2(g) = CO2(g)+ 2 H2O(l);⊿H = -890.3kJ/ mol
相同质量的H2、、、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A、H2、(g)、 B、CO (g) C、C8H18 (l) D、CH4(g)
3、已知在101 kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2mol CH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6﹒30倍,CH4完全燃烧反应的热化学方程式是
考点4:元素周期律
复习建议:强调基本知识——1~20号元素的序数、结构、位置
主族元素的原子结构、原子半径、化合价、性质递变规律
周期表的结构、氢键
1、下列说法正确的是
A 常温常压下,只有一种元素的单质呈液态
B 周期表中所有元素都有从自然界中发现的
C 过渡元素不全是金属元素
D 常温常压下,气态单质的分子都是由非金属元素的原子形成的
2、右表为元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙中正确的是
A 常压下五种元素的单质中Z单质的沸点最高
B Y、Z的阴离子电子层结构都与R原子的相同
C W的氢化物沸点比X的氢化物的沸点高
D Y元素的非金属性比W元素的非金属性强
${图片1显示}
3、同一主族的两种元素的原子序数之差不可能是
A 16 B 26 C 36 D 46
4、.短周期元素X、Y的原子序数相差2。下列有关叙述正确的是
A.X与Y不可能位于同一主族
B.X与Y一定位于同一周期
C.X与Y可能形成共价化合物XY
D.X与Y可能形成离子化合物XY
5、下列说法正确的是
A、H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B、在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C、HI的相对分子质量大于HF,所以HI的沸点高于HF
D、由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
6、下列分子中所有原子都满足最外层为8电子结构的是
A SiCl4 B H2O C BF3 D PCl5
考点5:电解质溶液
化学反应速率、化学平衡理论适用于弱电解质的电离、盐的水解
1、相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
A 弱酸溶液产生较多的氢气 B 强酸溶液产生较多的氢气
C 两者产生等量的氢气 D 无法比较两者产生氢气的量
2.关于小苏打水溶液的表述正确的是
A.c(Na+) = c(HCO3—)+ c(CO32—)+ c(H2CO3)
B.c(Na+) + c(H+)= c(HCO3—)+ c(CO32—)+ c(OH—)
C.HCO3—的电离程度大于HCO3—的水解程度
${图片2显示}
3、欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3¯)都减少,其方法是
A 通入二氧化碳气体 B 加入氢氧化钠固体
C 通入氯化氢气体 D 加入饱和石灰水溶液
4、已知0.lmol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
${图片3显示}
6、关于电解NaCl水溶液,下列叙述正确的是
A 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
B 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C 电解时在阳极得到氯气,在阴极得到金属钠
D 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
${图片4显示}
${图片5显示}
措施是
A 加催化剂同时升高温度 B 加催化剂同时增大压强
C 升高温度同时充入N2 D 降低温度同时增大压强
考点7:氧化还原反应
复习建议: (1)氧化还原的相关概念、电子转移的方向和数量
(2)配平氧化还原方程式:注意有序进行
灵活处理:电荷守恒配平离子方程式
(3)氧化还原的简单计算:用得、失电子数相等关系
金属与酸、碱、水的反应,本质是失电子
1、ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3 + H2C2O4 + H2SO4 = 2ClO2↑ + K2SO4 +2CO2↑+2H2O
下列说法正确的是
A、KClO3在反应中得到电子 B、ClO2是氧化产物
C、H2C2O4在反应中被氧化 D、1mol KClO3参加反应有2mol电子转移
2.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag ==Tl+ + 2Ag+。下列推断正确的是
A.Tl+ 的最外层有1个电子 B.Tl3+ 的氧化性比Al3+弱
C.Tl能形成+3价和+1的化合物 D.Tl+ 的还原性比Ag强
#3、某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是
A KMnO4 B NaCl C (NH4)2SO4 D CH3COOH
4、已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是

6、将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出气体最多的是:
A、3mol/LHCl B、2mol/LHNO3 C、8mol/LNaOH D、18mol/LH2SO4
7、镁和镁的合金4.6克,完全溶于某浓度的HNO3,若反应中HNO3被还原只产生4480mL NO2气体和336 mL N2O4 气体(都已折算成标准状况),在反应后的溶液中,加入足量的NaOH溶液,生成沉淀的质量为
A 9.02g B 8.51g C 8.26g D 7.04g
考点8:摩尔的概念及阿伏加德罗常数
复习建议——引导学生用典型题目自我训练,查找知识漏洞
1、NA代表阿伏加德罗常数,下列说法正确的是
A 在同温同压时,相同体积的任何气体单质所含的原子数目相同
B 2g氢气所含原子数目为NA
C 在常温常压下,11.2L氮气所含的原子数目为NA
D 17g氨气所含电子数目为10NA
2、NA为阿伏加德罗常数,下列说法正确的是
A.10g甲烷所含有的电子数目为10NA
B.常温常压下,4g氦气所含有的中子数目为4NA
C.标准状况下,22.4L单质溴所含有的原子数目为2NA
D.电解食盐水若产生2g 氢气,则转移的电子数目为2NA
3、.下列说法正确的是
A 含有相同氧原子数的SO2和CO的质量相等
B 等物质的量浓度的NaOH溶液与氨水中的c(OH-) 相等
C 乙酸分子与甲酸甲酯分子中的共价健数相等
D 等温等压下,3mol C2H2(g)和1mol C6H6(g)的密度相等
4、设阿伏加德罗常数为NA,则下列说法正确的是
A、常温常压下,11.2L甲烷中含有的氢原子数为2NA
B、标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C、常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D、常温下,1L 0.1mol/LMgCl2溶液中含Mg2+数为0.2NA
II卷元素化合物复习建议:(1)熟记化学方程式
(2)抓元素周期律这一主线知识,选择具有代表性和典型结构、典型实验现象的物质为重点,注意知识的综合性和计算要求。
(3)训练提高阅读、审题、运用信息寻找突破口,进行推理的能力。
1、X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的 ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。

2、甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是 。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
。
(3)在一定条件下,甲与O2反应的化学方程式是 。
(4)丁的元素符号是 ,他的原子结构示意图为 。
(5)丁的氧化物的晶体结构与 的晶体结构相似。
3、下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。

请按要求填空:
(1)写出下列物质的化学式:A: ,E: F: ,Y: 。
(2)反应⑤的化学方程式为: 。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为: 。
化学实验复习建议:
1.重视教材、课本实验挖掘教材实验的深度,进行知识迁移,突出实验设计中创新能力的培养。
2.解答化学实验题的思考:
(1)实验原理,实验目的是什么?
(2)各仪器分别起什么作用?它涉及到什么物理原理?
(3)怎样安全操作?(气密性检查、可燃性气体验纯、有害尾气的处理、处理常见事故的一般方法)
(3)准确全面实验描述现象,包括:
溶液颜色变化,气体的生成及其颜色、气味,沉淀的生成或溶解,固体反应物的减少或消失,发光放热、反应速率、反应的剧烈程度.
(4)对各种实验现象加以解释、得出结论
(5)实验数据的处理:根据化学式或化学方程式列计算式.
(6)设计创新:评价实验方案、是否有其他方案?改用其它仪器或药品完成实验?
4、已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
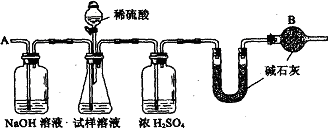
主要实验步骤如下:①按图组装仪器,并检查装置的气密性
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏
高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验法。
5、实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已知得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
|
实验 |
实验过程中所发生反应的化学方程式 |
实验所用仪器 |
实验需直接测定的有关物理量 |
|
1 |
|
| |
|
2 |
|
|
实验可能用到的主要仪器:
①托盘天平②启普发生器③硬质玻璃管④泥三角
⑤烧杯⑥坩埚⑦酒精灯⑧玻棒
⑨漏斗⑩干燥管
实验可能用到的试剂:
a.锌粒b.稀硫酸c.氯化钠溶液d.浓硫酸
6、有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。

请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? 。请简要说明两点理由:
① ;② 。
思考题:请设计实验方案,检验是否有Na2SO4生成(提示:排除HNO3和Na2O2的干扰)
设计简单实验方案举例:
1、某溶液中不存在 而有 ,如何用化学方法进行验证?
2.用实验室常用的试剂,用两种方法证明乙酸是一种弱酸.
3.设计不同的实验证明新制的氯水中含有
4.用胶头滴管将新制氯水慢慢滴入含酚酞的氢氧化钠溶液中,当滴入最后一滴氯水时,红色完全褪去.
(1)产生上述现象的原因可能有两种,分别是(用简要文字说明)
(2)假设原因可能是其中之一,则为证明红色褪去的原因究竟是①还是②,需做的实验及其结论是
答案:(1)①由于HCl中和NaOH溶液呈中性;②由于HClO漂白作用
(2)①再加少量NaOH溶液;②再加几滴酚酞
5.设计实验,证明苯酚与浓Br2水的反应是取代反应而不是加成反应.
答案:取一支试管,加入2mL苯酚溶液,向其中滴入浓溴水,当产生较多白色沉淀时,将试管静置片刻,取上层清液,用pH试纸测,显酸性.
6.(1)Na2O2与水反应的实验现象是__________,如何检验反应的生成物?
答案:加少量H2O,有无色无味气体生成,用带火星的木条检验.
得到无色溶液,滴入酚酞,变红色,后红色褪去.
(2)Na2O2加水所得溶液中,滴入酚酞后变红,很快又褪色.对此现象,甲、乙两位同学作出了如下推测:
甲查资料得知,当溶液中c(OH-)大于5mol/L时,变红的酚酞就能褪色,他认为这是酚酞褪色的原因.
乙推测:Na2O2与H2O反应时,还原H2O2生成,他认为是H2O2的漂白性导致酚酞褪色.
请你设计实验,评价甲和乙的判断.
答案:若甲的推测正确,则所得溶液加大量水稀释,再滴入酚酞,溶液不褪色.
取反应后的清液,加MnO2,若有气泡,且能使带火星的木条着火,乙的判断正确.
有机化学复习建议:(1)熟练掌握— 卤代烃、醇、醛、羧酸、酯的性质及转化;
(2)落实书写化学方程式
(3)常见考点—有机物的官能团及名称;判断反应类型;根据分子式、官能团、同分异构,书写有机物的结构简式;书写有机化学方程式,同分异构体;推断有机物:
(4)新教材增加“有机物分子式和结构式的确定”
(5)选用图形简洁、难度适中、有梯度的题
7、某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量(分子量)是 。
(3)该化合物的化学式(分子式)是 。
(4)该化合物分子中最多含 个- -官能团。
8、苏丹红一号(sudan Ⅰ)是一种偶氮染料,不能作为食品添加剂使用。它是由苯胺和2-萘酚为主要原料制备的,它们的结构简式如下所示:
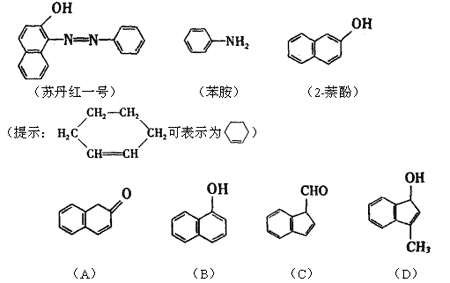
(1)苏丹红一号的化学式(分子式)为
(2)在下面化合物(A)~(D)中,与2-萘酚互为同分异构体的有(填字母代号) 。
(3)上述化合物(C)含有的官能团是
(4)在适当的条件下,2-萘酚经反应可得到芳香化合物E(C8H6O4),1molE与适量的碳酸氢钠溶液反应可放出二氧化碳44.8L(标准状况),E与溴在有催化剂存在时反应只能生成两种一溴代物,两种一溴代物的结构简式分别是 ,E与碳酸氢钠反应的化学方程式是 。
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是 ,反应类型是 。
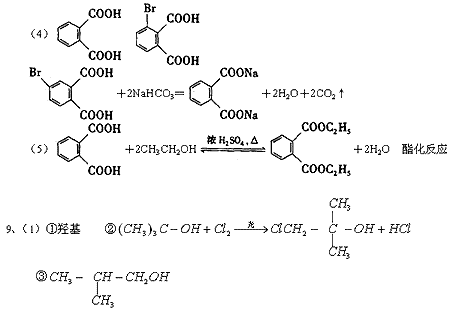
9、(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:

①A分子中的官能团名称是___________;
②A只有一种一氯取代物B。写出由A转化为B的化学方程式
___________________________________________________________;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。
F的结构简式是_____________________________________________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)_______________。
①加成反应 ②氧化反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是__________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。
“TBHQ”的结构简式是_____________________________。
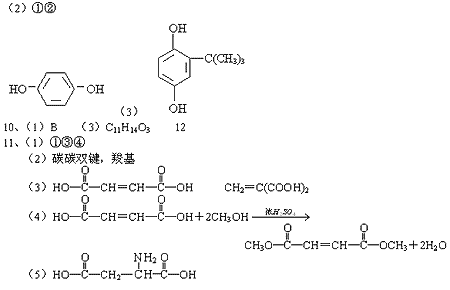
10、300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。
没食子酸的结构式为:

⑴ 用没食子酸制造墨水主要利用了_____________类化合物的性质(填代号)。
A.醇 B.酚 C.油脂 D.羧酸
⑵ 没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为_________。
⑶ 尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品添加剂。尼泊金丁酯的分子式为_________________,其苯环只与—OH和—COOR两类取代基直接相连的同分异构体有__________种。
⑷ 写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:
____________________________________________________________。
11、有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有 (选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是 、 。
(3)B分子中没有支链,其结构简式是 ,B的具有相同官能团的同分异构体的结构简式是 。
(4)由B制取A的化学方程式是 。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:

天门冬氨酸的结构简式是 。
部分习题参考答案
考点1 1B 2C 3C 4C 5B 6略 7D 8C
考点2 1B 2B 3C 4D 5BC 考点3 1C 2B 3B
考点4 1D 2D 3D 4C D 5D 6A 考点5 1A 2AD 3D 4C 5B 6B
考点6 1A 2AB 3B 4C 5B 考点7 1AC 2C 3A 4A 5C 6A 7B
考点8 1D 2D 3C 4C
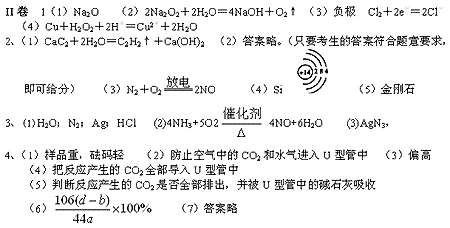

(以上三种方法任选两种,其它合理的方法也给分)
6、(1)2Na2O2+2SO2=2Na2SO3+O2(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
7、(1)4个 (略) (2)134 (3)C5H10O4 (4)1
8、(1)C16H12N2O
(2)(A)(B)(C)
(3)碳碳双键 醛基